Fosfat
Fosfat, je u neorganskoj hemiji so fosforne kiseline. U organskoj hemiji, fosfat, ili organofosfat, je estar fosforne kiseline. Organski fosfati su važni u biohemiji i biogeohemiji ili ekologiji. Neorganiski fosfati se iskopavaju da bi se dobio fosfor za upotrebu u agrikulturi i industriji.[2][3][4] Na povišenim temperaturama u čvrstom stanju, fosfati mogu da se kondenzuju i formiraju pirofosfate.
Hemijske osobine
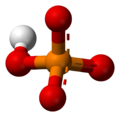
Fosfatni jon je poliatomski jon sa empirijskom formulom -{PO}-43− i molarnom masom od 94.973 g/mol. On se sastoji od jednog centralnog atoma fosfora atom okruženog sa četiri atoma kiseonika u tetraedarskoj konfiguraciji. Fosfatni jon nosi tri negativa formalna naelektrisanja i on je konjugovana baza hidrogen fosfatnog jona, -{HPO}-42-, koji je konjugovana baza -{H}-2-{PO}-4-, dihidrogen fosfatnog jona, koji je konjugovana baza -{H}-3PO4, fosforne kiseline. On je hipervalentni molekul (atom fosfora ima 10 elektrona u svojoj valentnoj ljuski). Fosfat je takođe organofosforno jedinjenje sa formulom -{OP(OR)3}-.
Fosfatne soli se formiraju kad se pozitivno-naelektrisani jon veže za negativno-naelektrisane atome kiseonika, formirajući jonsko jedinjenje. Mnogi fosfati nisu rastvorni u vodi na standardnoj temperaturi i pritisku. Natrijum, kalijum, rubidijum, cezijum i amonijum fosfati su rastvorni u vodi. Većina drugih fosfata su veoma malo rastvorni ili nerastvorni u vodi. Kao pravilo, hidrogen i dihidrogen fosfati su nešto rastvorniji od korespondirajućih fosfata. Pirofosfati su uglavnom rastvorni u vodi.
U razređenim vodenim rastvorima, fosfat postoji u četiri oblika. U jako-baznoj sredini, fosfatni jon (-{PO}-43−) predominira, dok u slabo-baznim uslovima, hidrogen fosfatni jon (-{HPO}-42−) je prevalentan. U slabo-kiselim uslovima, dihidrogen fosfatni jon (-{H2PO4−}-) je najzastupljeniji. U jako-kiseloj sredini, fosforna kiselina (-{H3PO4}-) je glavna forma.
-
-{H3PO4}- -
-{H2PO4−}- -
-{HPO42−}- -
-{PO43−}-
Precizniji, polazeći od sledeće tri ravnotežne reakcije:
- -{H3PO4}- Шаблон:Eqm -{H+}- + -{H2PO4−}-
- -{H2PO4−}- Шаблон:Eqm -{H+}- + -{HPO42−}-
- -{HPO42−}- Шаблон:Eqm -{H+}- + -{PO43−}-
korespondirajuće konstante disocijacije na 25 °-{C}- (u mol/L) su:
- (pKa1 2.12)
- (pKa2 7.21)
- (pKa3 12.67)