Хемоглобин

Хемоглобин је металопротеин за пренос кисеоника који садржи гвожђе и налази се у црвеним крвним зрнцима код кичмењака. Хемоглобин преноси кисеоник из плућа или шкрга у остале делове тела, као што су нпр. мишићи. Он повећава преносни капацитет за кисеоник у литру крви са 5 на 250 -{ml/l}-. Хемоглобин има и кључну улогу и при преносу -{CO}-2 и водоникових јона.
Име хемоглобин се састоји од речи хем и глобин, и на тај начин показује да је хемоглобин глобуларни протеин који садржи хем групу. Хем група се састоји од органског дела и атома гвожђа који је одговоран за везивање кисеоника.
Емпиријска хемијска формула најчешћег људског хемоглобина је -{C}-2952H4664N812O832S8Fe4.
Структура
Код људи, хемоглобин се састоји од четири протеинске подјединице. Свака подјединица се састоји од протеинског ланца који је везан са непротеинском хем групом. Сваки протеински ланац се уређује у алфа-хеликс.
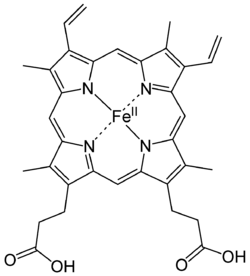
Атом гвожђа у хем групи се везује са четири атома азота у средишту порфиринског прстена. Исти атом може да створи и две додатне везе, по једну са сваке стране равни хема. Та везивна места се зову пето и шесто координационо место. Оксидациони број атома гвожђа у хему може бити +2 и +3. Аналогни облици хемоглобина се зову ферохемоглобин и ферихемоглобин. Ферихемоглобин се још зове и метхемоглобин. Само хемоглобин оксидационог стања +2 може да веже кисеоник.[1]|first=Cowan J.
Хемоглобин се састоји од четири пептидна ланца. У молекулу хемоглобина постоје четири места на којима се веже кисеоник, јер сваки ланац садржи један хем. Четири полипептидна ланца су везана један за други соним мостовима, водоничним везама и хидрофобним интеракцијама.[2]
Хемоглобин А, главни хемоглобин код одраслих, састоји се од два пара међусобно једнаких ланаца који се зову -{α}-- ланци, тј. -{β}-- ланци. Ови ланци могу доћи у додир на два начина: -{α}-1β1 и -{α}-2β2. Појединачна грађа хемоглобина А се означава као -{α}-2β2.[2]
Тродимензионалну структуру хемоглобина А су одредили Макс Перуц и његови сарадници. Рендгеноструктурном анализом је утврђено да је молекул хемоглобина готово кугласт, пречника 5,5 -{nm}-. Четири ланца су тетраедарски распоређена. Хемови су смештени у процепима близу површине молекула, по један у свакој подјединици. Четири везивна места за кисеоник су међусобно веома удаљена. Сваки -{α}--ланац је у контакту са оба -{β}-- ланца, док је између два -{α}-- ланца и два -{β}-- ланца мало интеракција.[2]
Оксидационо стање гвожђа у хемоглобину
Одређивање стања оксидације хемоглобина је тешко зато што је оксихемоглобин дијамагнетик (нема неспарених електрона), али нискоенергијске конфигурације -{е}-- у -{О}-2 и -{Fe}- су парамагнетичне. Триплет кисеоника, врста која има најнижу енергију, има два неспарена -{е}-- у антивезивним π* молекулским орбиталама. -{Fe}-(II) настоји да буде у високоспинској конфигурацији где су неспарени -{е}-- у антивезивним орбиталама. -{Fe(III)}- има непаран број -{е}--, па самим тим и неспарене -{е}--. Сви ови молекули су парамагнетични, тако да неинтуитивна расподела -{е}-- мора постојати да би подстакла дијамагнетизам.
Постоје три могућности:
- Нискоспински -{Fe}-2+ се веже за високо-енергијски триплет -{О}-2. Нискоспински -{Fe}- и синглет -{О}-2 су дијамагнетици.
- Високо-спински -{Fe}-2+ се веже за -{О}-2- (супероксид јон) и а
- Нискоспински -{Fe}-4+ веже се за -{О}-2-. Обоје су дијамагнетици.
Право оксидативно стање -{Fe}- је +3, а -{О}-2 је -1. Дијамагнетизам у овој конфигурацији потиче од неспарених -{е}-- супероксида који се поравнавају антиферомагнетички у супротним смеру од неспарених -{е}-- гвожђа.
Прелазак -{Fe}- у више оксидационо стање смањује величину атома и омогућава му да уђе у раван порфиринског прстена навлачећи координиран остатак хистидина и иницирајући алостеричне промене виђене код глобулина. Одређивање стања оксидације је само формализам, тако да сва три модела могу допринети у одређеној мери.
Ранији постулати су тврдили да је прва могућност исправна и да -{Fe}- треба да постоји у стању -{Fe(II)}-. Присуство синглета кисеоника никада није објашњено.
Кооперативност молекула хемоглобина
Улога хемоглобина је да преноси кисеоник из плућа, шкрга или коже животиња до њених капилара, из којих хемоглобин прелази у ћелије у којима се користи у процесима дисања. Количина кисеоника која може да се раствори, нпр. у телесним течностима била би довољна само за врло мале животиње. Већи организми захтевају постојање протеина као што је хемоглобин који ће да преноси веће количине кисеоника.[1]
Молекул хемоглобина може максимално да веже четири молекула кисеоника и његова крива везивања има сигмоидалан облик.[1]

Сигмоидална крива везивања може да се подели у три дела: при ниским концентрацијама лиганада степен везивања се врло мало повећава са порастом концентрације лиганада, средњи део почиње у тачки у којој при малом порасту концентрације лиганада настаје велики пораст у степену везивања, а завршава се у тачки у којој при даљем повећавању концентрације лиганада не долази до повећања степена засићења. Овакво понашање одговара кооперативном понашању.[1]
Можемо квантитативно да утврдимо физиолошко значење сигмоидалне природе криве Hb: О2 интракције, односно биолошки значај кооперативности. То постижемо помоћу Хилове једначине:
Она описује везу између -{pO}-2, афинитет хемоглобина ка кисеонику (дефинисан као p50, парцијални притисак кисеоника на коме је достигнута половина од максимума сатурације хемоглобина са кисеоником), и односа фракције хемоглобина везаног са кисеоником, -{Y}-, и фракције хемоглобина без везаног кисеоника, (-{1-Y}-). Коефицијент -{n}- је Хилов коефицијент, индекс кооперативности криве.[3]
Механизам везивања кисеоника за хемоглобин
Промене у константама дисоцијације, до којих долази са повећањем степена везивања кисеоника за хемоглобин, указује да је овај процес праћен променама у структури места где се везивање дешава. С обзиром да се структура везивног места не може мењати независно од структуре целог молекула протеина, структуре хемоглобина са и без везаног кисеоника се међусобно разликују. Везивање кисеоника узрокује такве конформационе промене у молекулу хемоглобина, да се разликују оксихемоглобин и деоксихемоглобин. Оксихемоглобин настаје током дисања, када се кисеоник везује за хем у еритроцитима. Деоксихемоглобин је облик хемоглобина без везаног кисеоника. У деоксихемоглобину се налази већи број соних мостова, који се у оксихемоглобину раскидају. Конформација деоксихемоглобина је стабилна (компактнија) и назива се Т стање, а конформација оксихемоглобина која је мање стабилна (релаксирана) назива се -{R}- стање. Конформације појединачних низова се обележавају као т односно -{r}- стање.[4]
У т стању -{Fe(II)}- се налази око 0,6 -{Å}- изван равни хема према хистидину. При везивању кисеоника за хем мења се електронска густина гвожђа у хему, веза -{Fe- Nporfin}- се смањује за 0,1 -{Å}- и гвожђе улази у раван хема, повлачећи хистидин -{F8}-, који са собом повлачи и -{F}- хеликс.[4]
Привлачење -{F}- хеликса изазива промене у контактима међу различитим подјединицама: ако се кисеоник веже за хем у -{β}-1подјединици, доћи ће до промена у контактима између -{β}-1 и -{α}-2 подјединице. Међутим, пошто су контакти између -{α}-2β1 подјединица непроменљиви, померање између α1β2 изазваће симетрично померање између друге две α2β1 подјединице. Тако ће везивање кисеоника за једну подјединицу изазвати њен прелазак из т у -{r}- конформацију, а то ће изазвати и прелазак конформације целокупног хемоглобина из Т у -{R}- стање. На тај начин ће све подјединице бити у -{r}- стању које је погодно за везивање кисеоника.[4]
Примећено је да оксидација значајно мења кватернарну структуру хемоглобина. Кристали деоксихемоглобина се поремете када су изложени кисеонику. Рендгенска кристалографска анализа је показала да се оксихемоглобин и деоксихемоглобин приметно разликују у кватернарној структури. Као што је већ речено, постоје две врсте -{αβ}- контаката: α1β1 и α2β2 контакти, који садрже хеликсе -{B, G}- и -{H}- и -{GH}- угао. Ови контакти су пространи и важни за подјединично паковање. Они остају непромењени када хемоглобин прелази из деокси у окси облик. α1β2 и α2β1 контакти се зову клизни контакти и они садрже хеликсе -{C}- и -{G}- и -{FG}- угао. Када хемоглобин претрпи конформациону промену као резултат везивања лиганада за хем, долази до промене ових контаката.[3]
Алостерна својства хемоглобина
На афинитет хемоглобина за везивање кисеоника утиче већи број малих молекула: -{H}-+, -{CO}-2, -{Cl}--, метаболит из гликолизе 2,3-дифосфоглицерат (-{BPG}- ). Код хемоглобина се јављају хомотропни и хетеротропни ефекти. Везивање кисеоника за хемоглобин резултује у позитивном хомотропном ефекту, док су -{H}-+, -{CO}-2, -{Cl}--, -{BPG}-, негативни хетеротропни ефектори за везивање кисеоника. Чиниоци који померају криву дисоцијације оксихемоглобина удесно (олакшавају отпуштање кисеоника) су: пад pH вредности у крви, пораст концентрације -{CO}-2, пораст температуре крви, док су чиниоци који је померају удесно -{HbF}-, пад концентрације -{CO}-2.[1]
Везивање -{CO}-2 за хемоглобин
У аеробном организму на један потрошен молекул кисеоника настаје око 0,8 молекула -{CO}-2. Већина -{CO}-2 се преноси као -{HCO}-3- који се ствара у еритроцитима деловањем карбоанхидразе[1]:
-{CO}-2 + -{H}-2О ↔ -{HCO}-3- + -{H}-+
Крв са високим процентом -{CO}-2 има нижи -{pH}- (киселија је). Хемоглобин може да везује протоне, а -{CO}-2 који проузрокује конформационе промене у протеину олакшава ослобађање кисеоника. Протони се везују на различитим местима у протеину, а -{CO}-2 се везује за алфа-амино групу при чему формира карбамат:
-{R-NH}-2 + -{CO}-2 ↔ -{R- NHCOO}-- + -{H}-+
Обрнуто, када ниво -{CO}-2 у крви опада, -{CO}-2 и протони су ослобођени из хемоглобина, при чему се повећава афинитет протеина за кисионик. Ова контрола афинитета хемоглобина према кисеонику, тако што се везује и ослобађа -{CO}-2 и киселина, је позната под називом Боров ефекат.
Везивање -{BPG}--а за хемоглобин
-{BPG}- се везује у централној шупљини деоксихемоглобина електростатичким интеракцијама са позитивно наелектрисаним бочним остацима аминокиселина које се ту налазе. BPG стабилизује Т конформацију, повезујући β- подјединице -{Т}- конформације хемоглобина, што снижава афинитет хемоглобина за кисеоник. Прелазак -{Т}- → -{R}- приближава две β- подјединице и избацује -{BPG}- напоље.[1]
Везивање -{CO}- за хемоглобин
Угљен-моноксид се такмичи са кисеоником око места на ком ће се везати у хему. Афинитет хемоглобина према -{CO}- је две стотине пута већи, него афинитет према кисеонику, што значи да и мале количине -{CO}- знатно смањују способност хемоглобина да преноси кисеоник. Када се -{CO}- веже за хемоглобин настаје светло црвено једињење које се зове карбоксихемоглобин.
На сличан начин хемоглобин има компетитивни афинитет према -{CH}--, -{SO}-, -{NO}-2 и S2-. Они везани за гвожђе у хему не мењају његово оксидационо стање, али изазивају велику токсичност.
Улога у болести
Смањење хемоглобина, независно од промене броја еритроцита, доводи до анемије. Узроци анемије су различити, иако је недостатак гвожђа један од главних узрока. Еритроцити тада постају хипохромични (мањак црвеног пигмента) и микроцитични (мањи него нормални).
Друге анемије су ретке. Једна од таквих је српаста анемија, која се јавља код афричких и америчких црнаца. До овакве анемије доводи мутантни хемоглобин, -{HbS}- у којем је остатак -{Gly}- А3(6)β, који се налази на површини молекула хемоглобина. Деоксихемоглобин има особину да се агрегира у чврста влакна која се простиру целом дужином еритроцита. До агрегације -{HbS}- долази у капиларима, где је -{pO}-2 низак, а концентрација деоксихемоглобина висока. Агрегација -{HbS}- деформише еритроците и даје им карактеристичан српасти облик. Ови еритроцити су мање стабилни од нормалних и лако хемолизују.
Хемоглобин А се у мањој мери комбинује и са глукозом на одређеним местима у молекулу, при чему настаје -{Hb}- А1-{c}-. Са порастом концентрације глукозе у крви, расте и проценат хемоглобина А који се претвара у -{Hb}- А 1-{c}-. Код дијабетичара чији је ниво глукозе висок, проценат -{Hb}- А1-{c}- се такође веома повећава. Због спорог комбиновања хемоглобина А са глукозом, проценат -{Hb}- А1-{c}- се мери у крви.
Улога у дијагностици
Мерење нивоа хемоглобина је један од најчешће извођених тестова крви. Резултати се приказују у -{g/l}-, -{g/dl}- или -{mol/l}-. Ако укупан хемоглобин падне испод тачно одређене вредности наступа анемија. Нормалне вредности за ниво хемоглобина су:
• Жене: 12,1 — 15,1 -{g/dl}-
• Мушкарци: 13,8 — 17,2 -{g/dl}-
• Деца: 11 — 16 -{g/dl}-
• Труднице: 11 — 12 -{g/dl}-
Анемије се могу поделити у односу на величину еритроцита на микроцитичне (мала величина еритроцита), нормоцитчне (нормална величина еритроцита) и макроцитичне (велики еритроцити). Приликом донације крви ради се тест на хемоглобин.
Ниво глукозе може веома да варира из сата у сат, тако да само са једним узорком глукозе пацијента се не могу добити репрезентативни резултати на глукозу. Зато се узорак крви може анализирати на ниво -{Hb}- А1-{c}-, што даје тачније резултате за дужи временски период. Нормални резултати треба да су 6% или мање. Овакав тест је нарочито користан за дијабетичаре.
Функционалне разлике миоглобина и хемоглобина
Хемоглобин је алостерни протеин, а миоглобин није. Та разлика се осликава на три начина:[2]
- Везивање првог молекула кисеоника на хемоглобин помаже везивање других молекула кисеоника у истом молекулу хемоглобина. Кисеоник се на хемоглобин везује кооперативно, док то није случај код миоглобина.
- Афинитет хемоглобина према кисеонику зависи од -{pH}-, а афинитет миоглобина не зависи.
- Афинитет хемоглобина према кисеонику одређују и органски фосфати попут дифосфоглицерата. Везивање фосфата смањује афинитет хемоглобина према кисеонику, па је онда он мањи него код миоглобина.
Референце
Литература
- Шаблон:Cite book|first=Cowan J.
- Шаблон:Cite book
- Шаблон:Cite book
- Шаблон:Cite book
- Шаблон:Cite book
- Шаблон:Cite journal
- Шаблон:Cite book
- Шаблон:Cite book
- Шаблон:Cite journal
Шаблон:Cite journal Шаблон:Литература крај